Из чего состоит атом? Инфографика
Содержание
Из чего состоит атом? Инфографика
 В 1913 году датский физик Нильс Бор предложил свою теорию строения атома. За основу он взял планетарную модель атома, разработанную физиком Резерфордом. В ней атом уподоблялся объектам макромира — планетарной системе, где планеты двигаются по орбитам вокруг большой звезды. Аналогично в планетарной модели атома электроны движутся по орбитам вокруг расположенного в центре тяжёлого ядра.
В 1913 году датский физик Нильс Бор предложил свою теорию строения атома. За основу он взял планетарную модель атома, разработанную физиком Резерфордом. В ней атом уподоблялся объектам макромира — планетарной системе, где планеты двигаются по орбитам вокруг большой звезды. Аналогично в планетарной модели атома электроны движутся по орбитам вокруг расположенного в центре тяжёлого ядра.
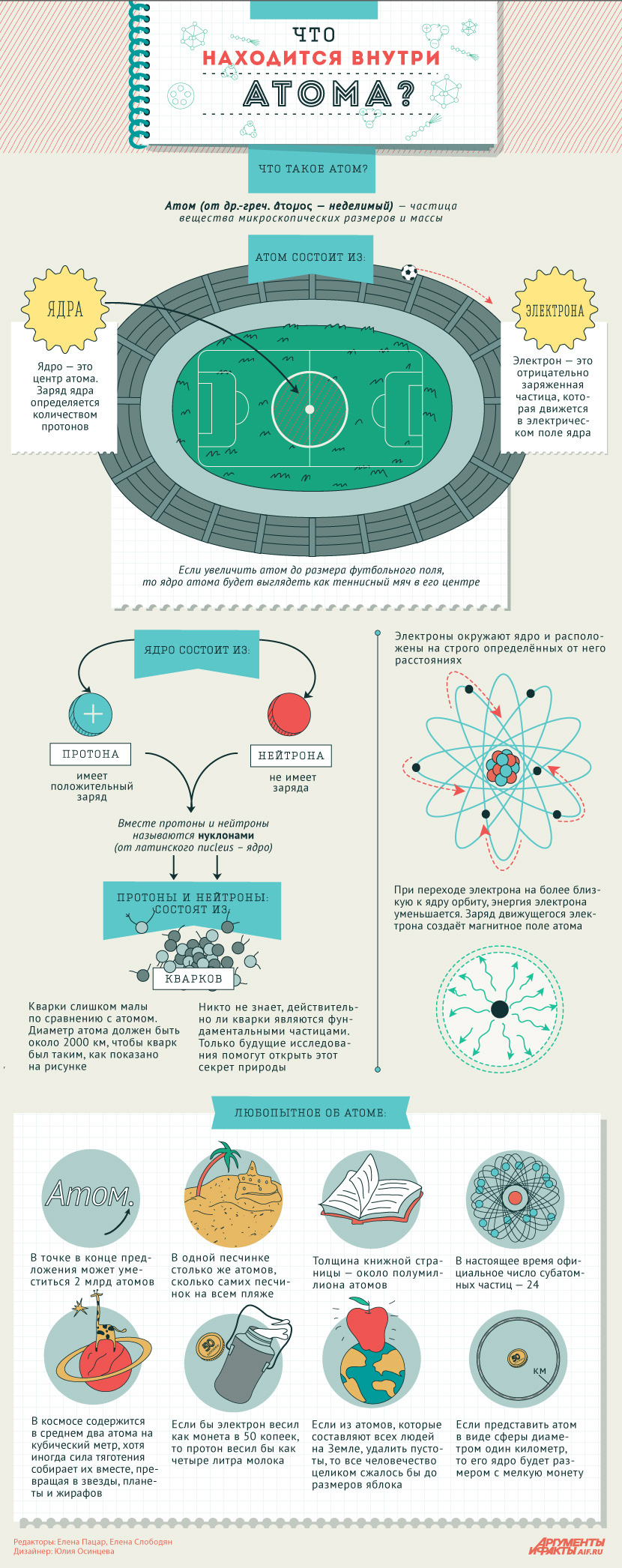
Бор ввёл в теорию атома идею квантования. Согласно ей, электроны могут двигаться только по фиксированным орбитам, соответствующим определённым энергетическим уровням. Именно модель Бора стала основой для создания современной квантово-механической модели атома. В этой модели ядро атома, состоящее из положительно заряженных протонов и не имеющих заряда нейтронов, тоже окружено отрицательно заряженными электронами. Однако согласно квантовой механике, для электрона нельзя определить какую-то точную траекторию или орбиту движения — есть только область, в которой находятся электроны с близким энергетическим уровнем.
Строение атома
История открытия. Демокрит. Начала атомистики
Уже в древности философы задумывались, из чего же состоит природа вокруг них. Демокрит первым из античных ученых предположил, что все в мире состоит из крошечных неделимых частиц. Эту частицу он назвал атом, что в переводе с греческого означает «неделимый».
К сожалению, возможности ученых в те времена были весьма ограничены. Каких-либо приборов, позволяющих исследовать строение вещества, у них не было. Но значение Демокрита в зарождении атомистики невозможно сбросить со счетов истории.
Атомно-молекулярное учение. Строение атома
Практически до середины XVIII века, пока М.В. Ломоносов не принес в химию количественные эксперименты, учение об атомах оставалось лишь прерогативой философских размышлений. Михаил Васильевич считал, что лишь знание физических законов поможет правильно истолковать результаты химических опытов.
В своих исследованиях ученый выделил в веществе крупные частицы — «корпускулы», и мелкие — «элементы», или как мы называем их сейчас — атомы.
Ломоносов считал, что каждая молекула по своему составу идентична всему веществу, а также, что различные по химическому строению элементы имеют и разные по составу молекулы. Ученый предполагал, что вещества имеют особенности не только из-за отличий в составе молекул, но и благодаря различному расположению атомов в молекуле.
Следующий шаг в изучении атомов сделал английский естествоиспытатель Джон Дальтон. Проводя различные эксперименты с растворением газов в жидкостях, ученый открыл главное физическое качество атомов: эти мельчайшие частицы имеют вес. Но поскольку атом до сих пор никто не видел, Дальтон назвал вес частицы относительным. Он установил, что самым легким элементом является водород и предложил его вес принять за единицу.
Открытие Дальтона стало прорывом в химии. Ведь теперь к любому химическому соединению можно было подойти с измерительным прибором. Это исследование позволило приблизиться к современной записи химических формул и уравнений. И именно Дальтон придумал первые обозначения для известных химических элементов.
До конца XIX века, несмотря на все старания ученых, химическое строение атома по-прежнему оставалось лишь гипотезой.Ученым не хватало оборудования, чтобы постичь тайну мельчайшей частицы.
Открытие Дальтона дало толчок дальнейшим опытам, в ходе которых ученые вычислили относительную атомную массу разнообразных химических элементов, что позволило их классифицировать, а Д.И.Менделееву – сформулировать периодический закон и представить научному миру Периодическую систему химических элементов.
Протоны и нейтроны
Обнаружение катодных лучей немецким ученым-физиком Юлиусом Плюккером в 1859 году и создание прототипа электронной трубки Ульямом Круксом в 1879 году положили новый виток исследованиям в атомистике.
Однако потребовалось еще несколько десятков лет, чтобы строение атомов химических элементов приоткрыло свои тайны. на заре XX века в одном журнале появились две публикации, которые пытались объяснить структуру атома. Одна из публикаций принадлежала английскому ученому Д.Д. Томсону, автором другой был японский физик Хантаро Нагаока.
Нагаока описал в статье так называемую «сатурнианскую» модель атома. Он думал, что атом по своей структуре напоминает планету Сатурн. В его центре находится массивное ядро с положительным зарядом, а электроны с отрицательными зарядами передвигаются вокруг ядра по орбитам. .
При создании своей атомной структуры Нагаока использовал разработанную Максвеллом в 1856 году теорию устойчивости колец Сатурна. Японский ученый был убежден, что опираясь на «сатурнианскую» модель ядра в будущих исследованиях, можно прояснить все основные свойства материи.
Исследователь ошибся, однако два постулата его теории впоследствии подтвердились:
- ядро атома имеет значительную массу;
- электростатические силы удерживают электроны на орбите (сходство с кольцами Сатурна, что удерживаются благодаря гравитационным силам).
Томсон выдвинул гипотезу о том, что атом напоминает шарообразную, электронейтральную сферу диаметром около 10 –10 м, где положительный заряд равномерно распределен по всей структуре атома, а электроны хаотично расположены в этом поле. Поэтому, можно сказать, что атом напоминает микроскопическую булочку с изюмом.
Опыты продолжались в разных странах. В лаборатории Резерфорда проходили испытания, которые смогли доказать, что в центре атома расположено крупное ядро с диаметром около —10 —15 м, в котором содержится более 99,95 % его массы, а заряд его положительный.
Ученые продолжали исследования с катодным излучением, и выяснили, что масса ядра была примерно в два раза больше, чем масса всех протонов в нем. Опираясь на это знание, Резерфорд выдвинул гипотезу, что в ядре атома присутствует еще некая тяжелая частица, лишенная заряда. С биографией выдающегося ученого можно кратко ознакомиться в учебнике «Введение в естественно-научные предметы» , под редакцией А.Е. Гуревич.
В 1932 году и Джеймс Чедвик обнаружил нейтрон — третий недостающий элемент атома.
Атомное взаимодействие обеспечивает тесную связь протонам и нейтронам в ядре атома. Протоны и нейтроны имеют общее название — нуклоны. Ученые считают, что их характеристики достаточно подобны, чтобы отнести эти частицы к одному семейству, как биологи относят в один вид собак и волков.
Казалось бы, вот оно – тайна ядра разгадана. Но нет, в современной физике считается, что нуклоны состоят из еще более мелких частиц, которые называют кварками, и кварковая модель является ведущей в современной науке.
Эксперименты по исследованию атома и его ядра не прекращаются, и в 2010 году международная группа физиков при исследовании протонов в мюонном водороде установила, что размер радиуса протона меньше на 4%, чем считалось до этого.
Так в фундаментальную физику ворвалась загадка протонного радиуса, почему измерение одной и той же величины в обычном и в мюонном водороде дает разные результаты — и, несмотря на усилия сотен специалистов, она до сих пор не решена.

Изотопы
Работая в лаборатории Резерфорда, Фредерик Содди экспериментально установил, что встречаются атомы одного химического элемента с различной атомной массой. А поскольку к этому времени уже было известно, что количество протонов для ядра постоянно, соответственно, отличались они количеством нейтронов.
Содди предложил термин изотоп (от греческих слов изос — «равный» и топос — «место») для обозначения веществ, идентичных по химическим свойствам, но отличающихся атомной массой и определенными физическими свойствами.
При графической записи изотоп выглядит как знак химического элемента, которому он соответствует. А что бы обозначить разницу, в массовом числе используют индекс слева вверху: ( 12 C, 222 Rn)
Протий, дейтерий, и тритий — исторические собственные названия изотопов водорода.
- стабильные (устойчивые);
- нестабильные (радиоактивные).
Электронное строение атома
Исследование таинственного микромира продолжается. Изучение движения электронов и внутриатомных взаимодействий выделилось в отдельную область физики — квантовую механику. Главный постулат квантовой механики — все волны обладают свойствами частиц, а микрочастицы имеют волновую природу.
В макромире физическое тело всегда находится в какой-то конкретной точке пространства. Даже если вы сфотографируете летящую муху и на фотографии она будет в виде черной полосы, вы все равно будете уверены, что в конкретный момент времени она была в определенном месте.
В мире атома все иначе. Легкий подвижный электрон находится одновременно во всех точках околоядерного пространства. Если провести аналогию с макромиром, больше всего это напомнит неплотный клубок мягкой пушистой шерсти.
И именно эта зона пространства, где существует вероятность встретить электрон, называется электронным облаком. Плотность электронного облака неравномерна.
В электронном облаке выделяют зону, где вероятность встречи с электроном более 90% — эта область обозначена как атомная или электронная орбиталь.
Все электроны в атоме обладают определенной энергией. Чтобы описать состояние электрона, ученые используют квантовые числа. Всего их четыре. Целое число n, которое определяет энергию электронов на конкретном энергетическом уровне, называют главным квантовым числом.
На одной электронной оболочке находятся атомные орбитали с единым значением главного квантового числа n.
У невозбужденного атома электроны расположены на орбиталях 4-х видов: s, p, d и f.
Но почему нельзя было обозначить буквами по алфавиту a, b, c? Все не так просто, для обозначения атомных орбиталей ученые решили использовать начальные буквы от прилагательных, описывающих спектральные линии в атомных спектрах:
- s (sharp) — резкая,
- p (principal) — главная,
- d (diffuse) — диффузная,
- f (fundamental) — фундаментальная.
Чтобы графически представить расположение электронов на уровнях и подуровнях атомной оболочки, ученые ввели электронные формулы. Это такие численно-буквенные комбинации, где подуровень обозначен строчной латинской литерой, а цифровой индекс вверху справа обозначает количество электронов на подуровне.
Например, атом водорода имеет один электрон, который расположен на s-подуровне 1-го энергетического уровня: 1s 1 . Электроны углерода расположены на двух энергетических уровнях, на внешнем энергетическом уровне у углерода выделяют два подуровня 2s и 2p, где находятся 4 электрона. Также используется графическая схема строения атома.
Для наглядности строения атомной оболочки углерода и процессов в ней можно воспользоваться схемой , представленной на нашем ресурсе.
Несмотря на свои способности быть одновременно в любой точке пространства, электроны при заполнении орбиталей соблюдают определенный порядок:
- Принцип наименьшей энергии. Электроны занимают атомные орбитали от наименьшей энергии к наибольшей. Распределение подуровней по энергиям представлено рядом : 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, где от 1s до 7p — энергия увеличивается.
- Принцип Паули — на одной орбитали помещается два электрона. Суммарное количество электронов в одном электронном слое или на одном электронном уровне равно 2n2.
- Правило Хунда — прежде чем начать собираться в пары, электроны сначала в пределах подуровня по одному занимают вакантные орбитали.
У этого правила есть еще одно мнемоническое название — правило троллейбуса. Расположение электронов напоминает рассадку в общественном транспорте. Если есть свободные места и человек входит один, он сядет на свободное сиденье, и только если нет свободных сидений, подсядет к кому-то на свободное место.
Итак, подведем выводы, на которые ученым понадобилось более сотни лет опытов, исследований, научных дискуссий и даже трагедий.
- Форма атома — сфера.
- Ядро и электронная оболочка — составные структуры атома.
- По электронной оболочке движутся электроны с отрицательным зарядом.
- Масса ядра составляет основную часть массы атома, т.к. протон весит примерно в 2000 раз больше электрона.
- Радиус атома приблизительно в 100000 раз больше чем радиус ядра.
- Атомное ядро состоит из нуклонов: протонов (p+) и нейтронов (n0), которые состоят из кварков.
- Количество протонов N(p+) равно заряду ядра (Z) и порядковому номеру элемента в периодической системе элементов, т.е. N(p+) = Z
- Количество электронов в нейтральном атоме равно количеству протонов в его ядре.
- Массовое число представляет собой сумму протонов Z и нейтронов N и обозначается литерой А.
- Если атом приобретает лишние электроны или теряет свои, то его заряд изменяется и он превращается в ион с положительным или отрицательным зарядом, что можно увидеть на иллюстрации в учебнике «Введение в естественно-научные предметы» , под редакцией А.Е. Гуревич.

Чтобы проверить насколько хорошо усвоен материал, предлагаем вашему вниманию тест на тему «Строение атома» для 8-11 классов:
- Кто придумал название атом?
- Архимед
- Менделеев
- Демокрит
- Ломоносов
- Как называются частицы, из которых состоит ядро атома?
- нуклоны
- позитроны
- феромоны
- интерфероны
- На что, согласно теории Томсона, похож атом?
- на пирожок с повидлом
- на «Киевский» торт
- на булочку с изюмом
- на горшок с медом
- Какую форму имеет атом?
- сферическую
- цилиндрическую
- кубическую
- додекаэдрическую
- Как называется составная часть нуклона?
- тверк
- кварк
- парк
- трак
- Что не является изотопом водорода?
- дейтерий
- тритий
- радий
- протий
- Как называется атом, в котором число протонов не совпадает с числом электронов?
- изотоп
- ион
- нуклон
- борион
- Сколько электронов помещается на одной орбитали?
- 3
- 10
- 2
- 15
- Какая наука изучает движение электронов?
- квантическая химия
- механическая биология
- коллоидная математика
- квантовая механика
- Основная масса атома содержится?
- в ядре
- в электронах
- в орбиталях
- в протонах
#ADVERTISING_INSERT#







